Molnupiravir: Trotz fehlender Zulassung seit 3.1. gegen COVID-19 verordnungsfähig
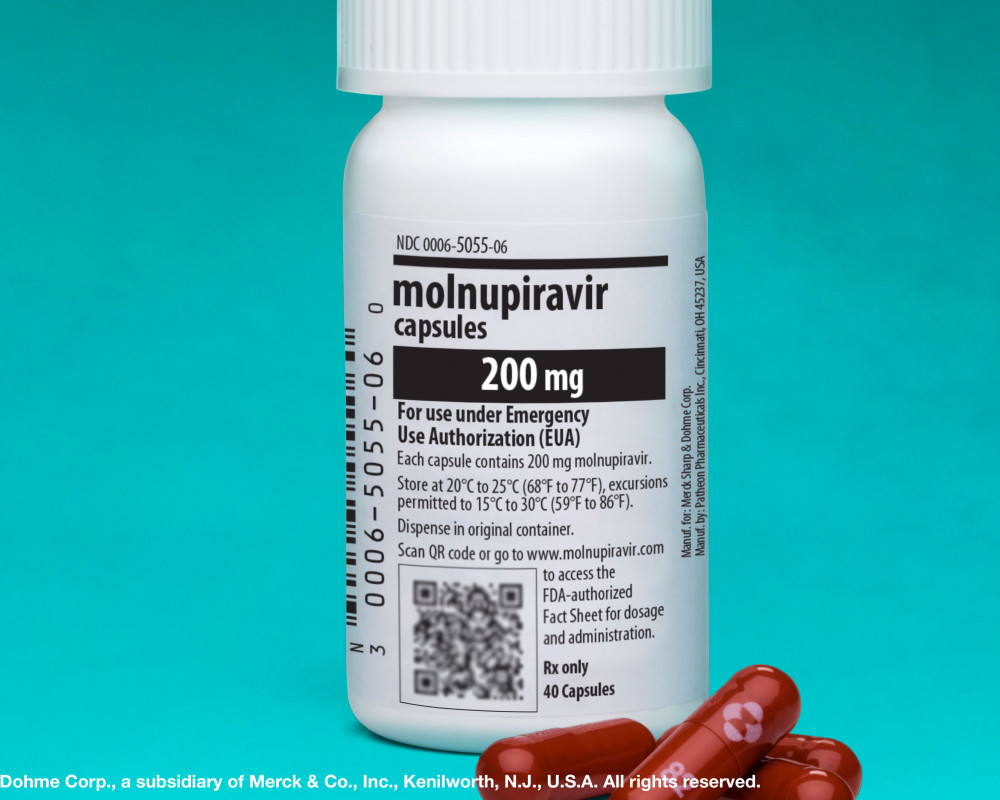
Das in der Europäischen Union noch nicht formell zugelassene Nukleosidanalogon Molnupiravir (Lagevrio®) wird in Deutschland mittels einer Ausnahmeregelung vom Bundegesundheitsministerium (BMG) beschafft. Nach Angaben des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) darf es ambulant bei über 18-Jährigen mit COVID-19 eingesetzt werden, wenn die Patienten ein erhöhtes Risiko für einen schweren Verlauf haben, aber keinen zusätzlichen Sauerstoff benötigen.
Verabreicht werden 2×4 Kapseln (je 200 mg) pro Tag (alle 12 Stunden) für fünf Tage. Die Therapie soll möglichst früh nach Symptombeginn starten. Schwangere dürfen das Medikament nicht anwenden. Frauen im gebärfähigen Alter müssen deshalb vor der Einnahme einen Schwangerschaftstest durchführen.
Bestellung
Die Arzneimittelkommission der Deutschen Apotheker (AMK) informiert darüber, dass Apotheken das Arzneimittel seit dem 3. Januar 2022 nach einer ärztlichen Verordnung auf einem normalen Muster 16 Formular beim Großhandel bestellen können. Die BUND-PZN für Lagevrio® lautet 17936094.
Die Verordnung darf nach § 4 Abs. 1 AMVV vom Arzt vorab telefonisch übermittelt werden, um Betroffene möglichst schnell zu versorgen. Der Großhändler hat das Arzneimittel unverzüglich an die bestellende Apotheke zu liefern. Eine Bestellung auf Vorrat ist nicht zulässig.
Abgabe
Nach dem Eintreffen in der Apotheke sollte Molnupiravir vorzugsweise im Rahmen des Botendienstes den Kranken ausgehändigt werden. Die Information und Beratung der Patienten kann auch auf dem Wege der Telekommunikation erfolgen. Da die vom Bund beschafften Arzneimittelpackungen von Lagevrio® für Großbritannien produziert wurden, sind sämtliche Angaben bis auf weiteres in englischer Sprache. Bei der Abgabe muss die Apotheke den Betroffenen daher
- ein vom Großhandel mitgeliefertes einseitiges Begleitschreiben der Firma MSD mitgeben.
- die „Hinweise für den Anwendenden“ ausgedruckt mitgeben. Sie können auf der Website des BfArM heruntergeladen werden.
Auch hat die AMK einen strukturierten Beratungs- und Dokumentationsleitfaden in Form einer Checkliste als Beratungs- und Abgabehilfe für die Apotheken erstellt.
Vergütung und Abrechnung
Die Zweite Verordnung zur Änderung der SARS-CoV-2-Arzneimittel-Versorgungsverordnung regelt, wieviel Geld Apotheken für die Beschaffung und Abgabe vom Bund beschaffter antiviraler Arzneimittel zur Behandlung von COVID-19-Erkrankungen erhalten. Danach bekommen sie 30 Euro pro Packung zuzüglich Umsatzsteuer. Acht Euro gibt es obendrauf, wenn das Medikament dem Kranken per Botendienst ausgehändigt wurde.
Der Deutsche Apothekerverband entwickelt derzeit einen Leitfaden zur Abrechnung, der laut DAZ.online vorraussichtlich bis spätestens Ende nächster Woche veröffentlicht werden soll. Der Pharmazeutischen Zeitung zufolge empfiehlt die ABDA keine Abrechnung entprechender Verordnungen vor dem 15. Januar. Erst dann werde Lagevrio® vorraussichtlich vollständig samt Berechnungsdatensatz in den Warenwirtschaftssystemen der Apotheken abgebildet sein.
Quelle: AMK, Ärzte Zeitung. DAZ.online, PZ